Pierwsze mikroskopy (optyczne) powstały w okolicach 1590 r. Dysponowały niewielkim powiększeniem (10 razy), więc nie zdobyły uznania jako instrumenty badawcze. Przełom nastąpił, gdy w XVII wieku Antoni van Leeuwenhoek udoskonalił i rozwinął produkcję tych urządzeń. Naukowcy wreszcie zaczęli badać, co dzieje się we wnętrzu organizmów żywych.
Od tego momentu, mikroskopia przeszła długą drogę. Obecnie jednym z najbardziej zaawansowanych urządzeń tego typu jest mikroskop sił atomowych (AFM), który pozwala na uzyskiwanie obrazów o rozdzielczości rzędu pojedynczych atomów dzięki badaniu sił oddziaływań międzyatomowych. AFM ujawnia szczegóły na poziomie atomowym w białkach i innych strukturach biologicznych w normalnych warunkach fizjologicznych, otwierając nowe okno na badanie komórek i wirusów. Teraz naukowcy z Weill Cornell Medicine opracowali technikę obliczeniową, która znacznie zwiększa rozdzielczość mikroskopów sił atomowych.
Jak podglądać białka?
Badanie białek z wysoką rozdzielczością jest możliwe dzięki dwóm podstawowym technikom: krystalografii rentgenowskiej i mikroskopii krioelektronowej. Pozwalają one na określenie struktury molekularnej danej cząsteczki z rozdzielczością pojedynczych atomów – sprawdzają się jednak tylko w przypadku cząsteczek, które są albo ułożone w sieć krystaliczną, albo zamrożone w niskich temperaturach.
Jest jeszcze trzecia technika – mikroskopia sił atomowych (AFM) – która umożliwia obserwowanie cząsteczek biologicznych w normalnych warunkach fizjologicznych, choć uzyskiwane obrazy mają niską rozdzielczość.
Technika ta przypomina trochę sytuację, w której bierzemy długopis i skanujemy Góry Skaliste, aby uzyskać mapę topograficzną obiektu. W rzeczywistości naszym długopisem jest igła, która jest ostra aż do grubości kilku atomów, a obiektami są pojedyncze cząsteczki białka.prof. Simon Scheuring z Weill Cornell Medicine
Cząsteczki biologiczne (np. białka) są złożone z fragmentów o różnej gęstości, które ponadto często się poruszają, co powoduje rozmywanie obrazów w AFM. Zespół prof. Scheuringa znalazł sposób, by ten problem rozwiązać. Wystarczyło zaadaptować koncepcję znaną z mikroskopii świetlnej – mowa o tzw. fluorescencyjnej mikroskopii super-rozdzielczej, ze szczególnym uwzględnieniem Super-resolution optical fluctuation image scanning microscopy (SOFISM).
Teoretycznie nie było możliwe w mikroskopii optycznej, aby uchwycić dwie fluorescencyjne cząsteczki, które były bliżej siebie niż połowa długości fali światła. Ale poprzez stymulowanie sąsiednich cząsteczek do fluorescencji w różnym czasie, można analizować rozprzestrzenianie się każdej z nich i precyzyjnie określać ich położenie.prof. Simon Scheuring
Co to daje?
Zespół Scheuring doszedł do wniosku, że zamiast stymulować fluorescencję, wystarczy rejestrować naturalne fluktuacje cząsteczek biologicznych podczas badania AFM. Dzięki temu z próbki można wydobyć maksimum informacji.
Wykorzystując mikroskopię SOFISM, naukowcy dopięli swego. Udało się im uzyskać obrazy poruszających się cząsteczek z dużą rozdzielczością. Prof. Scheuring użył kolejnej topograficznej analogii:
Jeśli kamienie (czyli atomy) poruszają się trochę w górę i w dół, można wykryć ten, potem tamten, a następnie uśrednić wszystkie detekcje w czasie i otrzymać informacje o wysokiej rozdzielczości.
Naukowcy mają nadzieję, że nową technikę łączącą ATM z SOFISM uda się wykorzystać do analizy pozyskiwanych przez dziesięciolecia zdjęć. Dobrym przykładem może być tu ponowna analiza obrazów AFM białka błonowego (obecnego w błonie komórkowej) zwanego akwaporyną, pierwotnie uzyskanych podczas pracy doktorskiej Scheuringa. Dzięki ponownej analizie uzyskano ostrzejszy obraz, który odpowiada strukturom odwzorowanym przy pomocy krystalografii rentgenowskiej tej cząsteczki.
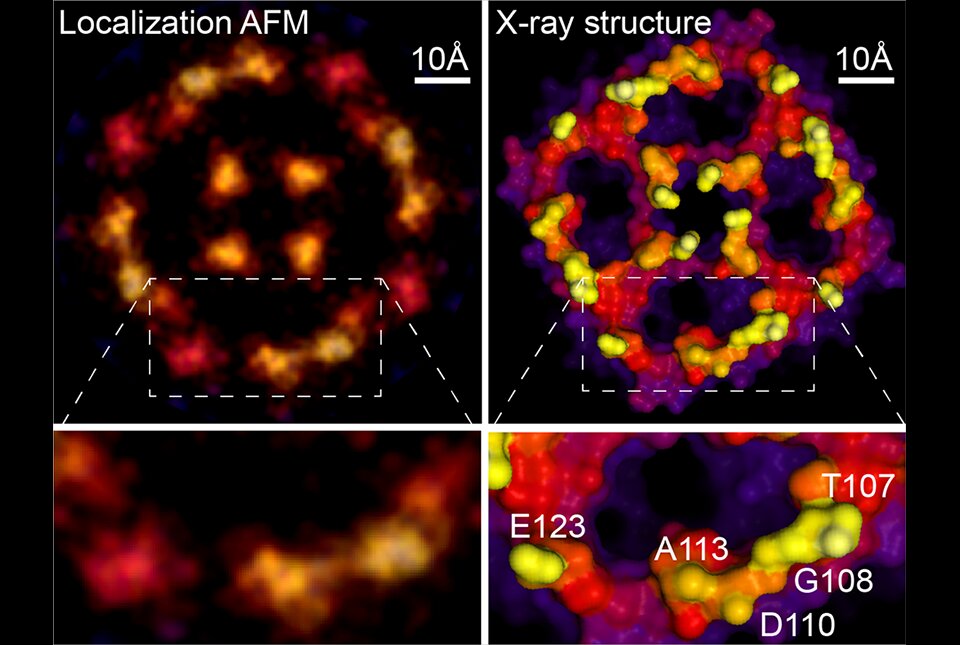
Nowa metoda umożliwia naukowcom badanie cząsteczek biologicznych w warunkach fizjologicznych, ale to nie jedyna korzyść. Krystalografia rentgenowska i mikroskopia krioelektronowa bazują na uśrednianiu danych pozyskiwanych z dużej liczby cząsteczek, podczas gdy AFM generuje obrazy z pojedynczych cząsteczek.
Zamiast obserwacji setek cząsteczek, obserwujemy jedną cząsteczkę sto razy i tworzymy jej mapę o wysokiej rozdzielczości.prof. Simon Scheuring
Oglądanie pojedynczych cząsteczek podczas wykonywanych przez nie funkcji fizjologicznych może zaowocować stworzeniem zupełnie nowych rodzajów obrazowania. Mogą one doprowadzić nie tylko do stworzenia zupełnie nowych klas leków, ale także do namierzenia celów terapeutycznych różnych patogenów, także wirusów.
Załóżmy, że mamy wirusowe białko szczytowe, które jest w jednej konformacji, a następnie zostaje aktywowane i przechodzi w inną konformację. W zasadzie można by stworzyć mapę o wysokiej rozdzielczości z tej samej cząsteczki, gdy przechodzi ona z jednej konformacji do następnej, a nie z tysięcy cząsteczek w jednej lub drugiej konformacji. To znacznie ułatwia badania.prof. Simon Scheuring
Dane pochodzące z pojedynczych cząsteczek są lepsze pod kilkoma względami. Przede wszystkim uzyskuje się je szybciej, ale przy tym są precyzyjniejsze, bo nie bazują na uśrednianiu, dając często niejednoznaczne wyniki. Połączenie AFM z SOFISM może być prawdziwym przełomem w mikroskopii, na który czekamy od lat.